
健康科普
提供最全最新的医疗资讯,打造最具权威性的医学健康知识科普平台。
脐带、胎盘来源的间充质干细胞为什么无需配型
在影视剧中经常听到“器官移植”、“细胞移植需要配型”、“等待配型结果”等词语。全世界有70多亿人口,配型成功异常困难,以骨髓造血干细胞移植为例,配型成功率在几万至几十万分之一不等。而如今,医学界又提出胎盘、脐带间充质干细胞使用无需配型的说法,这所谓的“配型”,究竟指的是什么?

到底什么是配型?
配型,又称组织配型,核心为HLA分型匹配。HLA 是Human Leukocyte Antigen的简拼,即“人类白细胞抗原”,广泛分布于机体内几乎所有有核细胞的表面。
每个人的HLA千差万别,因此,HLA又有人体生物学的“身份证”之称。它是不同个体免疫细胞相互识别的标志,机体“区分敌我、识别自身、排除异己”的主要遗传标记,参与免疫应答反应,具有非常重要的生物学功能。
因此在进行细胞移植时,供受者之间的HLA匹配程度反映了供受双方的组织相容性程度,和移植手术后的排斥反应率密切相关,决定了移植成功或失败,故又将其称为移植抗原。
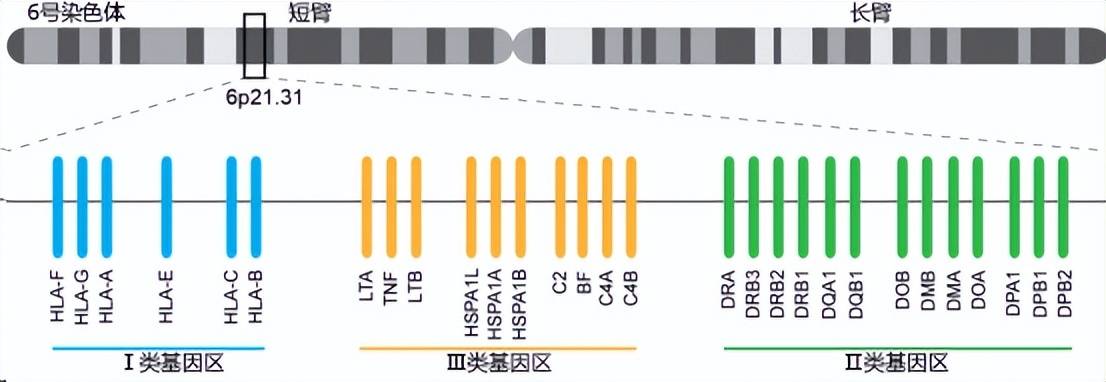
而编码这三个抗原的基因位于两条同源染色体上,一条来自父方,一条来自母方,因此,共3×2=6个位点。这也就产生了我们常听到的“全相合、4个位点相合、5个位点相合”这样的说法。
国内外大量的临床研究结果表明,受者和供者之间HLA相容程度越高,也就是受者和供者之间HLA-A、B、DR六个位点相合匹配的越多,排斥反应的发生率就越低,移植成功率就越高。反之,就越容易发生排斥反应,对患者术后的生存产生致命的危害。
配型为什么这么困难?
对于干细胞移植,简单来说就是要将供者健康的、正常的干细胞移植到病人体内,来替换病人因疾病丧失功能的病态的、异常的细胞。
比如公众广知的脐带血造血干细胞移植,或骨髓造血干细胞移植,就是先通过手术或放化疗的处理将体内原有的病态细胞杀死,再将供者的健康细胞移植入患者体内。这个过程中,一旦发生排斥反应,由于受者本身免疫系统通常极为脆弱,极易造成严重后果,引发患者死亡。

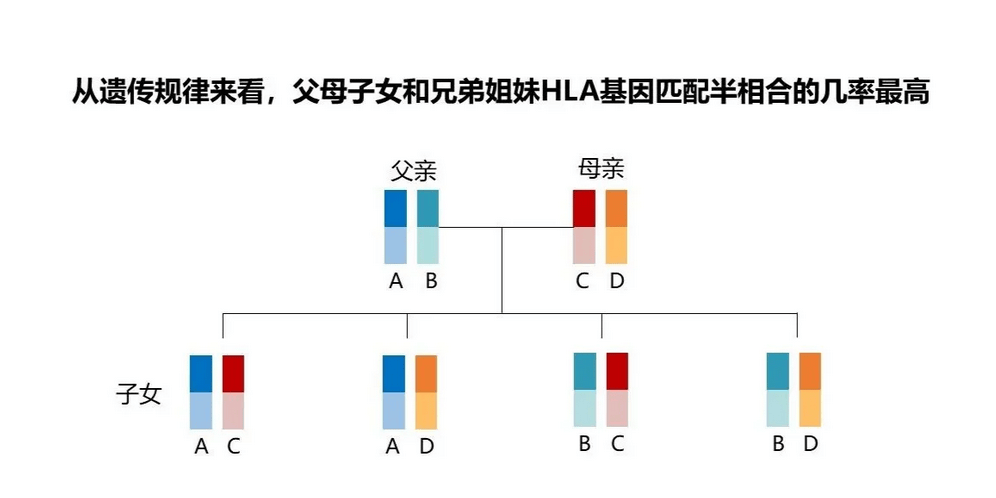
因此,在移植上,通常要求6个位点至少有4个相合。对于亲属来说,患者必然从父亲和母亲中各获得一条染色体,因而与父母的HLA为半相合。
而对于兄弟姐妹,根据排列组合有4种情况,与患者有HLA完全一致的可能性为1/4,因此在进行移植时,通常首选在同胞兄妹中找寻供者。
而对于无关供者来说,每一种抗原相应的等位基因有上百种,对应的特异性产物各自有数十种,如此复杂的基因及产物,可随机组合成一个巨大的数字,因此在随机人群中,难以有完全相同的HLA。
这也就造就了我们说的“配型成功异常不易”。此外HLA的基因分布还有一定的民族、地域特点,所以,临床上很少见到白种人或黑种人与黄种人配型成功,这也使得跨国移植的情况显得非常稀缺。
脐带/胎盘间充质干细胞为什么无需配型
胎盘、脐带间充质干细胞,主要指从新生儿胎盘或脐带组织中提取的一种叫做间充质干细胞的细胞。
医学上认为这类细胞的HLA抗原分子表达比较特殊,II类分子不表达(如HLA-DRB1),I类分子低表达。通俗理解,它们不会被机体的免疫系统识别。
间充质干细胞具有低免疫原性,经过体外培养后和体内输注MSC都不会引起T细胞的活化和增殖。并且MSC与胸腺上皮有部分相同的表面分子,如:VCAM 1、ICAM 2、LFA 3。这也就说明间充质干细胞为何具有免疫调节作用。

此外还有其它一些免疫相关分子不表达或低表达,这使得间充质干细胞可以逃避机体免疫系统的识别,避开宿主监视,因而输注到体内不会引发很强的排斥反应。因此,在临床上,使用无需进行配型。
另外,相较于其他来源,胎盘和脐带在发育上非常原始,其来源的间充质干细胞具有很强的免疫调节作用,可以抑制机体亢进的免疫反应,从而防止过度免疫应答可能对宿主组织造成的损伤。
临床上目前已有用脐带来源的间充质干细胞联合HLA半相合的造血干细胞进行共移植,来治疗重型再生障碍性贫血,结果发现可以明显降低并发症的发病率,加快造血重建,且降低GvHD(移植物抗宿主病)发生的风险,提高了移植存活率。这对于扩大造血干细胞移植供者范围,有着重大意义。
所以,造血干细胞的移植需严格配型,而间充质干细胞因其较低免疫原性和免疫调节功能,突破了脐血或骨髓来源的造血干细胞在移植时配型的限制,使得其在临床治疗上无需进行配型。
提早存储,以备不时之需
间充质干细胞是一种多能干细胞,可以向肌腱、血管、神经、脂肪、骨骼等多种组织分化,使其成为再生医学、组织器官损伤退行性疾病领域的研究热点。
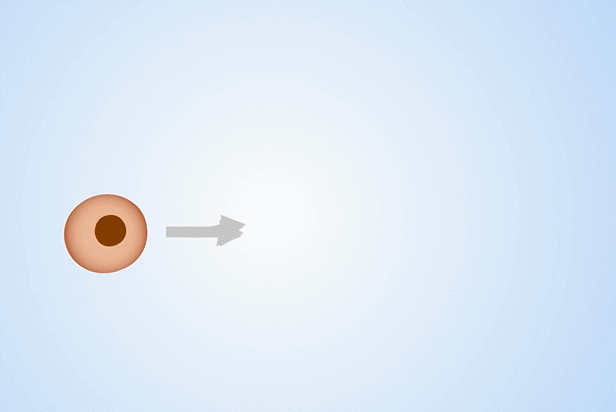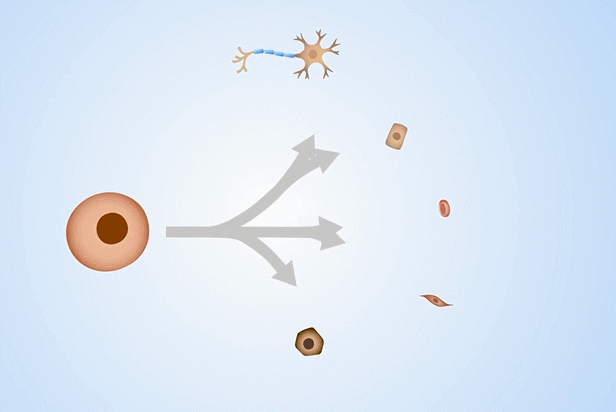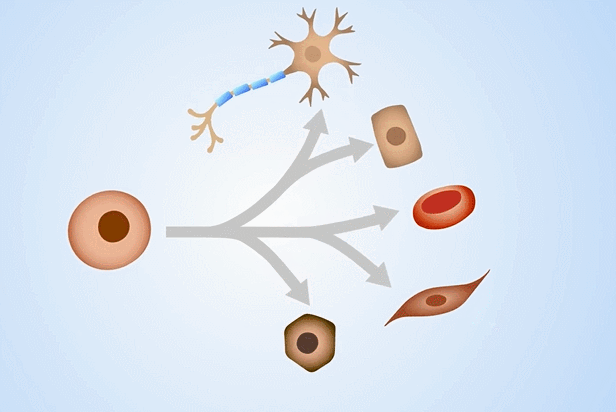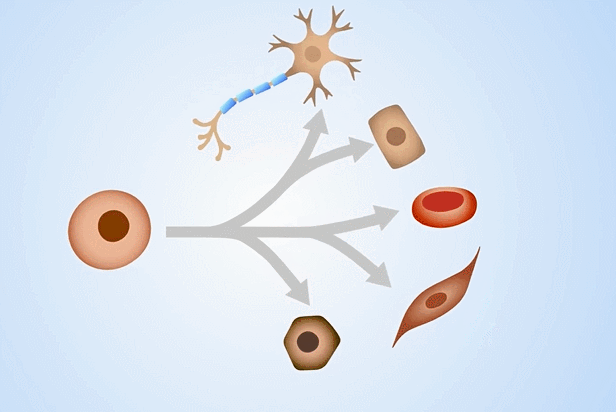
那么将来源及用途颇为广泛的、脐带及胎盘来源的间充质干细胞,冻存于-196℃的深低温液氮罐中长期保存,对于今后在医学方面的临床应用将有更为广阔的前景。

