
行业资讯
诺亚创生汇聚了行业内资讯内容,为您提供最新、最热的资讯内容。
中国首款干细胞治疗药品获批上市
2025年1月2日,国家药监局官网发布一则里程碑式的消息,我国首款干细胞治疗药品艾米迈托赛注射液上市,用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病(aGVHD)。

我国首个上市的干细胞疗法——艾米迈托赛
艾米迈托赛是一种基于间充质干细胞(MSC)的创新疗法。关于它的适应症,急性移植物抗宿主病(aGVHD)是异基因造血干细胞移植(allo-HSCT)后常见的严重并发症之一,主要涉及皮肤、肝脏和胃肠道等器官。
当前,针对II-IV级类固醇难治性aGVHD的治疗,临床上急需新的有效手段。传统的二线治疗药物如抗胸腺细胞球蛋白、依那西普等,虽然在一定程度上能缓解病情,但整体疗效有限,且伴随较多不良反应。因此,MSC疗法作为一种新兴的免疫调节治疗手段,逐渐受到关注。

hUC-MSC PLEB001(即艾米迈托赛)是一种来源于人脐带的间充质干细胞产品,经过体外培养并配方化后用于临床治疗。
近年来,越来越多的研究开始探索其在治疗aGVHD方面的潜力。一项由Donglin Yang等人发起的多中心、随机、双盲、安慰剂对照的II期临床试验,旨在评估艾米迈托赛在治疗II-IV级类固醇难治性aGVHD患者的疗效和安全性。

该试验在中国多家造血干细胞移植中心进行,共纳入了一定数量的患者。患者被随机分配至MSC组或安慰剂组,以1:1的比例接受hUC-MSC PLEB001或安慰剂治疗,同时接受常规二线治疗。MSC组患者每周接受两次hUC-MSC PLEB001输注,持续4周。治疗结束后,通过评估患者的整体响应率(ORR)、完全响应(CR)率、部分响应(PR)率以及安全性指标来评判疗效。
在II期临床试验的探索性分析中,尽管MSC组在第28天时与安慰剂组相比,并未显示出更高的总缓解率(ORR),但MSCs在平均2周后逐渐显现出治疗效果。特别是那些完成了8次输注的患者,尤其是肠道受累的患者,可能从MSCs治疗中获益显著。
艾米迈托赛目前已完成II期临床试验,III期临床试验也在紧锣密鼓地进行中。
间充质干细胞:潜力无限的医学瑰宝
2024年12月18日,美国FDA宣布,批准Mesoblast公司开发的Ryoncil(remestemcel)上市,用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD)。FDA的新闻稿指出,这是首个FDA批准的间充质基质细胞(MSC)疗法。

中美这两款获批药物均聚焦于间充质干细胞,这类干细胞源自中胚层,宛如生命的 “万能种子”,广泛分布于骨髓、脐带、脐带血及脂肪等人体组织器官,具备多向分化的卓越潜能,且拥有自我复制、低免疫原性、高活性、抑炎性和不成瘤性等五大显著特性,在再生医学与细胞治疗的前沿阵地展现出了惊人的应用潜力。
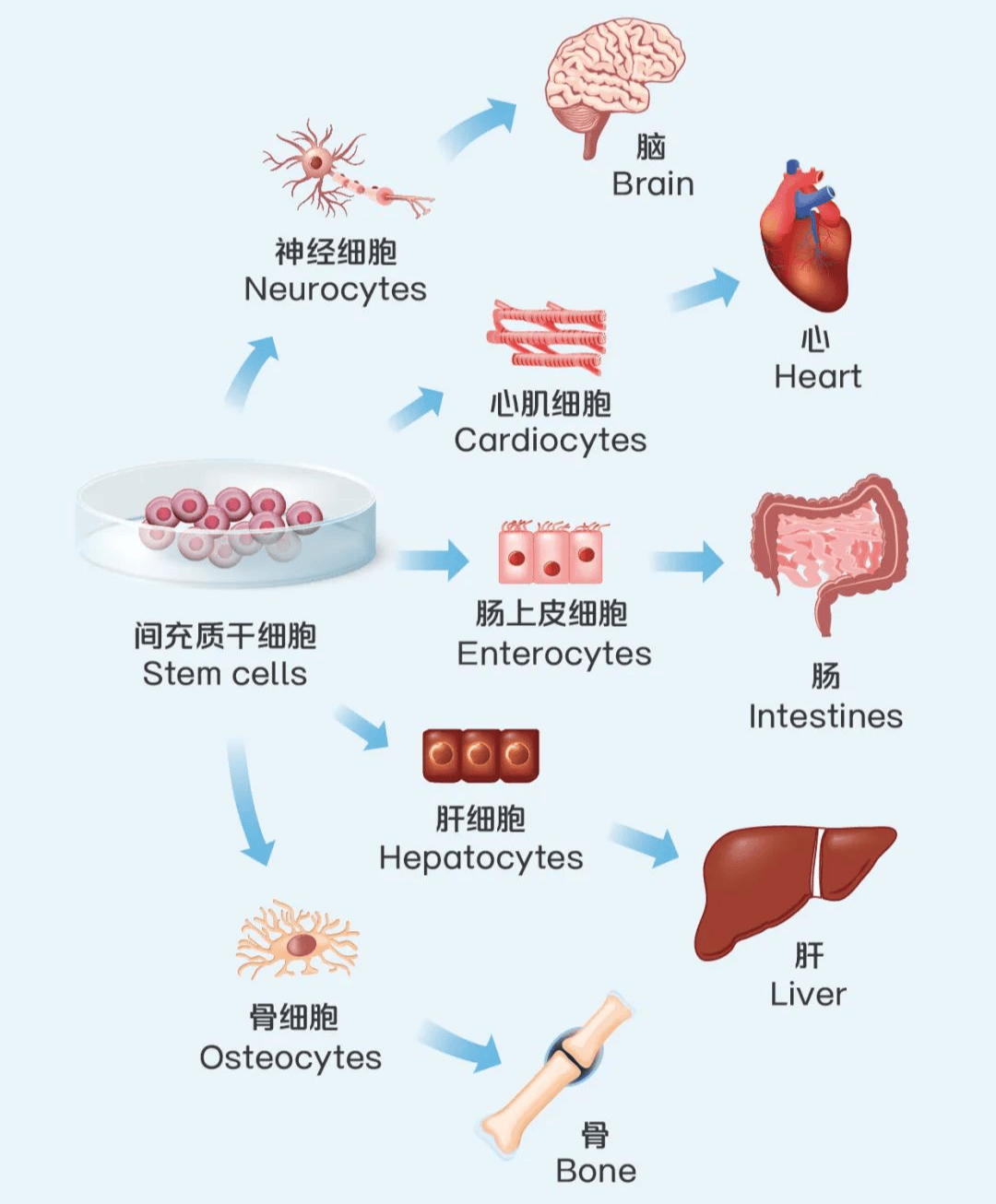
无论是国内还是国外,间充质干细胞都是干细胞疗法中最为热门的分类,在clinicaltrials.gov网站检索可知,当前全球已有1318项间充质干细胞项目进入临床研究阶段,在各类干细胞疗法中遥遥领先。目前全球获批上市的间充质干细胞治疗药品约10个,其细胞来源、适应症不尽相同。其中用于治疗急性移植物抗宿主病(aGVHD)的间充质干细胞治疗药品有4款,除我国批准的艾米迈托赛注射液外,还有美国、加拿大、日本等国家批准的骨髓间充质干细胞等不同技术路径的干细胞疗法。
细胞治疗产品是全球医药发展的前沿和热点。中美干细胞治疗产品的获批是具有划时代意义的重大突破,标志着干细胞疗法在临床应用的关键一跃,为再生医学与大健康产业推开了一扇通往无限可能的大门。以此为起点,干细胞疗法在多个适应症上的临床研究正在积极推进,其未来的发展潜力备受期待。

